Hogedrukbehandeling
Hogedrukprocessen voor de inactivering van micro-organismen zijn al enige tijd onderwerp van onderzoek en worden al met succes toegepast in speciale gebieden van de industriële praktijk. In deze hydrostatische hogedrukprocessen (HHP) worden de te behandelen materialen blootgesteld aan drukken van 6000-10000 bar (600 – 1000 MPa) om micro-organismen te doden [1]. De te behandelen materialen zijn meestal vloeistoffen of opgeloste stoffen. De behandeling van vaste stoffen is echter ook mogelijk, mits deze in een vloeistof (bijvoorbeeld water) kunnen worden gebracht. Het inactiverende effect op micro-organismen hangt echter af van het type micro-organisme; sommige soorten bacteriën zijn zeer goed bestand tegen HHP-behandeling [2]. Hiermee moet rekening worden gehouden tijdens de toepassing. Naast HHP zijn er andere hogedrukprocessen, zoals het onder hoge druk homogeniseren van vloeibare voedingsmiddelen [3]. Het voordeel van hogedrukprocessen is dat micro-organismen alleen kunnen worden geïnactiveerd door behandeling met hoge druk en zonder verhitting of toevoeging van biociden. Deze processen worden daarom beschouwd als residuvrij en bijzonder zacht. De oorspronkelijke eigenschappen van de behandelde goederen worden slechts licht gewijzigd door de processen[4]. Daarom worden hogedrukprocessen gebruikt bij de behandeling van voedingsmiddelen, specerijen, farmaceutische preparaten enz. Een andere bekende toepassing uit het dagelijks leven is de sterilisatie onder hoge druk van hoogwaardige en gevoelige producten, zoals verse directe sappen of vruchtenpurees, waarvan de smaak te veel zou veranderen door verhitting[5].
Deze eigenschappen maken HPP en soortgelijke processen in principe interessant voor de behandeling van afvalwater om specifiek de microbiële belasting te verminderen en ook multiresistente kiemen te doden. Deze processen hebben het voordeel dat er geen biociden worden gebruikt, die het afvalwater extra vervuilen met andere stoffen, of dat het afvalwater op een energie-intensieve manier wordt verhit, wat gepaard gaat met hoge kosten en andere problemen. Het genereren van extreem hoge drukken is echter technisch zeer veeleisend en stelt hoge technische en materiële eisen. Een alternatief voor HHP zijn processen op basis van samengeperste gassen zoals kooldioxide (CO₂), distikstofoxide (NO₂) of stikstof, die een vergelijkbaar inactiveringseffect hebben, zelfs bij een vergelijkbaar lage druk van minder dan 100 bar. Op dit gebied is zogenaamde dichte fase kooldioxide (DPCO₂ of DPCD) bijzonder effectief gebleken[6].
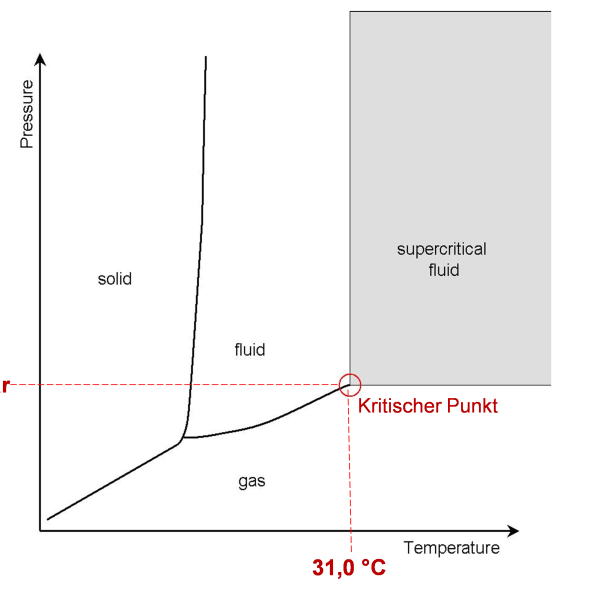
Kooldioxide (CO₂) is een gas dat in een concentratie van ongeveer 420 ppm (0,04 %) in de atmosfeer van de aarde voorkomt. Het gas komt de atmosfeer binnen via geologische processen of voornamelijk via de oxidatie van organische koolstof door technische en biologische processen. CO₂ is een product van veel metabolische processen, zoals celademhaling, en wordt door de meeste levende organismen uitgescheiden. De uitgeademde lucht van mensen bevat bijvoorbeeld 3-6 % CO₂. De dichtheid van gasvormig CO₂ is groter dan die van lucht, dus zinkt het naar de grond. Het is geur- en smaakloos, maar is zeer goed oplosbaar in water en vormt koolzuur in een waterige oplossing, waardoor de pH-waarde daalt. CO₂ sublimeert van de vaste naar de gasfase bij atmosferische druk bij -78,5 °C zonder vloeibaar te worden. Pas bij een druk van 5,2 bar en een temperatuur van < 56,6 °C, bij het zogenaamde tripelpunt, condenseert CO₂ tot een vloeistof. Dit wordt in de toepassing “vloeibare CO₂”, LCO₂, genoemd. Het kritische punt van CO₂ wordt bereikt bij 73,8 bar en 31 °C, waar het in de superkritische toestand komt (“superkritische CO₂”, SCCO₂). In deze toestand lossen de fasegrenzen op en vertoont SCO₂ zowel de eigenschappen van een gas als van een vloeistof: het heeft de lage viscositeit van gasvormig CO₂ en kan daarom heel gemakkelijk de fijnste poriën van vaste materialen binnendringen, maar is tegelijkertijd een goed oplosmiddel voor apolaire organische stoffen. Een schematisch fasendiagram wordt getoond in Fig. 1. De term “samengeperst kooldioxide” (dense phase carbon dioxide, DPCO₂) verwijst over het algemeen naar vloeibaar kooldioxide (LCO₂) of superkritisch kooldioxide (SCCO₂).
De waarneming dat CO₂ antimicrobiële eigenschappen heeft is al heel lang bekend. Hoewel het gas niet giftig is, kunnen CO₂-concentraties van >8% binnen 30-60 minuten tot de dood leiden. De “remmende effecten op microben” werden voor het eerst samengevat in 1927 [7]. Het antimicrobiële effect dat wordt veroorzaakt door de verplaatsing van zuurstof is een effect dat al duizenden jaren wordt gebruikt. Het speelt een rol tijdens de gisting van het beslag bij de productie van wijn en bier, omdat de CO₂ die tijdens de gisting wordt geproduceerd, voorkomt dat aerobe micro-organismen zoals schimmels, die bederf kunnen veroorzaken, kunnen groeien voordat het alcoholgehalte hoog genoeg is. Bovendien remt de vorming van kooldioxide de groei van micro-organismen. De toevoeging van kooldioxide aan dranken verbetert niet alleen de smaak, maar verlengt ook de houdbaarheid. Dit effect wordt al lange tijd gebruikt in de drankenindustrie [8].
Samengeperst CO₂ heeft echter ook antimicrobiële eigenschappen bij direct gebruik. De eerste onderzoeken waarbij gecomprimeerd CO₂ werd gebruikt om inactivatie te bereiken, werden al in 1951 gepubliceerd [9]. Sinds de jaren 1990 is de belangstelling voor DPCO₂-processen aanzienlijk toegenomen. Talrijke publicaties maken melding van werkzaamheid tegen bacteriën [2], [10], [11], [12], [13], [14], [15], [16], [17], [18], schimmels [19], [20], [21], [22], [23], af en toe bacteriële endosporen [11], [24], [25] en virussen [26], [27]. De vastgestelde inactivatiesnelheden variëren tot meer dan 9 log niveaus, afhankelijk van de gebruikte micro-organismen, de gebruikte fase (LCO₂ / SCCO₂), de temperatuur en druk en de incubatietijd.
Het exacte mechanisme waardoor DPCO₂ leidt tot het doden van micro-organismen is nog niet volledig opgehelderd. Verschillende onderzoeken hebben verschillende effecten aan het licht gebracht die ten grondslag liggen aan het antimicrobiële effect van gecomprimeerd kooldioxide. De volgende effecten werden in de onderzoeken gezien.
• Verzuring van de omgeving van de micro-organismen: Als er water aanwezig is wanneer micro-organismen in DPCO₂ geïncubeerd worden, wordt er koolzuur (H₂CO₃) gevormd. Dit verzuurt de omgeving. Verzuring verstoort de protongradiënten die belangrijk zijn voor de micro-organismen en tast zo het metabolisme van de cellen aanzienlijk aan. [28].
• De diffusie van de samengeperste CO₂ in het celmembraan, dat uit fosfolipiden bestaat, leidt tot een afname van de membraanfluïditeit. Dit verstoort de structuur en functie van het membraan aanzienlijk, waardoor het beter doorlaatbaar wordt voor andere stoffen. Hierdoor kunnen cytotoxische stoffen gemakkelijker de cel binnendringen en kunnen vitale stoffen uit de cel diffunderen. De cellen kunnen het metabolisch evenwicht niet langer handhaven [29], [30], [31].
• Daarnaast is DPCO₂ ook een uitstekend oplosmiddel. Hierdoor kunnen intracellulaire celbestanddelen worden opgelost en uit de cel worden geëxtraheerd. Het vrijkomen van bepaalde stoffen in het omringende medium kan zo worden gedetecteerd.[32]
• Samengeperst CO₂ dringt door het celmembraan in het cytoplasma van micro-organismen en leidt tot een intracellulaire verlaging van de pH-waarde door de vorming van koolzuur. De verlaging van de pH-waarde kan echter niet worden gecompenseerd met een massale instroom van CO₂ en leidt dan tot een verlaging tot pH=3,3. De verlaging van de intracellulaire pH-waarde leidt onder andere tot de inactivatie van pH-gevoelige sleutelenzymen van het celmetabolisme.[33], [34]
• De vorming van koolzuur in de cellen leidt ook tot een verandering in de ionenconcentratie. Tweewaardige metaalionen zoals Mg2+ en Ca2+ kunnen worden neergeslagen door de vorming van slecht oplosbare carbonaatzouten en hun neerslag. Deze ontbreken dan in het metabolisme als gradiënten of als cofactoren in enzymen. Hierdoor worden de processen in de cel ernstig verstoord.[35]
• Er wordt ook gediscussieerd over de vraag of de relaxatie van DPCO₂ celbreuken zou kunnen veroorzaken, aangezien de onder hoge druk in de cel gediffundeerde CO₂ uitzet tijdens de plotselinge relaxatie en overgaat in de gasfase [31].Beschadigde membranen kunnen worden herkend in beelden die met elektronenmicroscopen van behandelde bacteriën zijn gemaakt. Of dit effect echt relevant is, wordt betwist, aangezien er zeer weinig eiwitmateriaal uit de behandelde cellen ontsnapt.[36]
Al deze effecten vinden tegelijkertijd plaats en het kan niet worden uitgesloten dat ze synergetisch op elkaar inwerken.
Het gebruik van DPCO2 in technologische toepassingen is om vele redenen voordelig: het is niet brandbaar, niet explosief, niet giftig, niet allergeen, verdampt zonder residu, relatief goedkoop (~€0,30/kg), gemakkelijk verkrijgbaar en recycleerbaar. Desinfectie met DPCO2 wordt beschouwd als een niet-thermisch proces en staat ook bekend als koude pasteurisatie. Omdat het bij lage temperaturen plaatsvindt, kan het ook als energiebesparend worden beschouwd, omdat er geen energie-intensieve verwarming nodig is.
Terwijl desinfectie met DPCO₂ keer op keer besproken wordt, maar nog niet overal ingeburgerd is en het onderwerp is van dit onderzoeksproject, wordt DPCO₂ op veel andere gebieden al op industriële schaal gebruikt. Zo zijn er processen voor het extraheren van natuurlijke stoffen (bv. extractie van lupuline uit hop, verwijdering van cafeïne uit koffie), voor het impregneren van hout, voor het kleuren van plastic onderdelen en voor het behandelen van rijst en andere voedingsmiddelen. Er is hier al ervaring met DPCO2, waarop kan worden voortgebouwd.
Al deze eigenschappen maken het gebruik van DPCO₂ interessant voor de behandeling van afvalwater om het aantal multiresistente ziekteverwekkers op een grondstofbesparende manier terug te dringen. De projectpartner wfk – cleaning technologies institute e.V. heeft al uitgebreide ervaring in de omgang met DPCO₂ vanuit reeds afgeronde onderzoeksprojecten. Deze expertise kan worden ingezet bij de ontwikkeling van nieuwe processen om MRE in afvalwater te verminderen en vormt een belangrijke bouwsteen voor SPOWAR.
# Selected literature references:
[1] S. Koseki, M. Matsubara, und K. Yamamoto, „Prediction of a Required Log Reduction with Probability for Enterobacter sakazakii during High-Pressure Processing, Using a Survival/Death Interface Model“, Appl. Environ. Microbiol., Bd. 75, Nr. 7, S. 1885–1891, Apr. 2009, doi: 10.1128/AEM.02283-08.
[2] H. Gollwitzer u. a., „High Hydrostatic Pressure for Disinfection of Bone Grafts and Biomaterials: An Experimental Study“, Open Orthop. J., Bd. 3, Nr. 1, S. 1–7, Jan. 2009, doi: 10.2174/1874325000903010001.
[3] R. Levy, Z. Okun, und A. Shpigelman, „High-Pressure Homogenization: Principles and Applications Beyond Microbial Inactivation“, Food Eng. Rev., Bd. 13, Nr. 3, S. 490–508, Sep. 2021, doi: 10.1007/s12393-020-09239-8.
[4] R. Sehrawat, B. P. Kaur, P. K. Nema, S. Tewari, und L. Kumar, „Microbial inactivation by high pressure processing: principle, mechanism and factors responsible“, Food Sci. Biotechnol., Bd. 30, Nr. 1, S. 19–35, Jan. 2021, doi: 10.1007/s10068-020-00831-6.
[5] V. Chiozzi, S. Agriopoulou, und T. Varzakas, „Advances, Applications, and Comparison of Thermal (Pasteurization, Sterilization, and Aseptic Packaging) against Non-Thermal (Ultrasounds, UV Radiation, Ozonation, High Hydrostatic Pressure) Technologies in Food Processing“, Appl. Sci., Bd. 12, Nr. 4, S. 2202, Feb. 2022, doi: 10.3390/app12042202.
[6] H. T. Vo, T. Imai, T. T. Ho, T.-L. T. Dang, und S. A. Hoang, „Potential application of high pressure carbon dioxide in treated wastewater and water disinfection: Recent overview and further trends“, J. Environ. Sci., Bd. 36, S. 38–47, Okt. 2015, doi: 10.1016/j.jes.2015.04.006.
[7] G. Valley und L. F. Rettger, „THE INFLUENCE OF CARBON DIOXIDE ON BACTERIA“, J. Bacteriol., Bd. 14, Nr. 2, S. 101–137, Aug. 1927, doi: 10.1128/jb.14.2.101-137.1927.
[8] J. R. Donald, C. L. Jones, und A. R. M. MacLean, „THE EFFECT OF CARBONATION ON BACTERIA IN BEVERAGES“, Am. J. Public Health, Bd. 14, Nr. 2, S. 122–128, Feb. 1924, doi: 10.2105/AJPH.14.2.122.
[9] D. Fraser, „Bursting Bacteria by Release of Gas Pressure“, Nature, Bd. 167, Nr. 4236, S. 33–33, Jan. 1951, doi: 10.1038/167033a0.
[10] C. I. Wei, M. O. Balaban, S. Y. Fernando, und A. J. Peplow, „Bacterial Effect of High Pressure CO2 Treatment on Foods Spiked with Listeria or Salmonella“, J. Food Prot., Bd. 54, Nr. 3, S. 189–193, März 1991, doi: 10.4315/0362-028X-54.3.189.
[11] A. Enomoto, K. Nakamura, M. Hakoda, und N. Amaya, „Lethal effect of high-pressure carbon dioxide on a bacterial spore“, J. Ferment. Bioeng., Bd. 83, Nr. 3, S. 305–307, Jan. 1997, doi: 10.1016/S0922-338X(97)80999-3.
[12] H. Lin, N. Cao, und L. Chen, „Antimicrobial Effect of Pressurized Carbon Dioxide on Listeria monocytogenes“, J. Food Sci., Bd. 59, Nr. 3, S. 657–659, Mai 1994, doi: 10.1111/j.1365-2621.1994.tb05587.x.
[13] A. K. Dillow, F. Dehghani, J. S. Hrkach, N. R. Foster, und R. Langer, „Bacterial inactivation by using near- and supercritical carbon dioxide“, Proc. Natl. Acad. Sci., Bd. 96, Nr. 18, S. 10344–10348, Aug. 1999, doi: 10.1073/pnas.96.18.10344.
[14] F. Dehghani, N. Annabi, M. Titus, P. Valtchev, und A. Tumilar, „Sterilization of ginseng using a high pressure CO2 at moderate temperatures“, Biotechnol. Bioeng., Bd. 102, Nr. 2, S. 569–576, Feb. 2009, doi: 10.1002/bit.22059.
[15] C. Cinquemani, C. Boyle, E. Bach, und E. Schollmeyer, „Inactivation of microbes using compressed carbon dioxide—An environmentally sound disinfection process for medical fabrics“, J. Supercrit. Fluids, Bd. 42, Nr. 3, S. 392–397, Okt. 2007, doi: 10.1016/j.supflu.2006.11.001.
[16] L. Garcia-Gonzalez u. a., „Membrane permeabilization and cellular death of Escherichia coli, Listeria monocytogenes and Saccharomyces cerevisiae as induced by high pressure carbon dioxide treatment“, Food Microbiol., Bd. 27, Nr. 4, S. 541–549, Juni 2010, doi: 10.1016/j.fm.2009.12.004.
[17] A. Arbal u. a., „Dense phase carbon dioxide (DPCD) inactivation of microorganisms and enzymes, and its application in food: A review“, Food Chem. Adv., Bd. 5, S. 100782, Dez. 2024, doi: 10.1016/j.focha.2024.100782.
[18] T. Hochmuth, „Entwicklung neuartiger bioresorbierbarer Implantatmaterialien sowie kompatibler Sterilisationsverfahren“, wfk – cleaning technologies e.V., Krefeld; Dresden, Schlussbericht IGF-17455 BG, Sep. 2014.
[19] G. Ferrentino und S. Spilimbergo, „Non-thermal pasteurization of apples in syrup with dense phase carbon dioxide“, J. Food Eng., Bd. 207, S. 18–23, Aug. 2017, doi: 10.1016/j.jfoodeng.2017.03.014.
[20] G. J. Haas, H. E. Prescott, E. Dudley, R. Dik, C. Hintlian, und L. Keane, „INACTIVATION OF MICROORGANISMS BY CARBON DIOXIDE UNDER PRESSURE“, J. Food Saf., Bd. 9, Nr. 4, S. 253–265, Jan. 1989, doi: 10.1111/j.1745-4565.1989.tb00525.x.
[21] A. Bernhardt u. a., „Improved Sterilization of Sensitive Biomaterials with Supercritical Carbon Dioxide at Low Temperature“, PLOS ONE, Bd. 10, Nr. 6, S. e0129205, Juni 2015, doi: 10.1371/journal.pone.0129205.
[22] D. Mantoan und S. Spilimbergo, „Mathematical Modeling of Yeast Inactivation of Freshly Squeezed Apple Juice under High-Pressure Carbon Dioxide“, Crit. Rev. Food Sci. Nutr., Bd. 51, Nr. 1, S. 91–97, Dez. 2010, doi: 10.1080/10408390903044818.
[23] T. Parton, N. Elvassore, A. Bertucco, und G. Bertoloni, „High pressure CO2 inactivation of food: A multi-batch reactor system for inactivation kinetic determination“, J. Supercrit. Fluids, Bd. 40, Nr. 3, S. 490–496, Apr. 2007, doi: 10.1016/j.supflu.2006.07.022.
[24] J. Zhang u. a., „Sterilizing Bacillus pumilus spores using supercritical carbon dioxide“, J. Microbiol. Methods, Bd. 66, Nr. 3, S. 479–485, Sep. 2006, doi: 10.1016/j.mimet.2006.01.012.
[25] T. Watanabe u. a., „High Pressure Carbon Dioxide Decreases the Heat Tolerance of the Bacterial Spores“, Food Sci. Technol. Res., Bd. 9, Nr. 4, S. 342–344, 2003, doi: 10.3136/fstr.9.342.
[26] A. N. Efaq, N. N. N. Ab. Rahman, H. Nagao, A. A. Al-Gheethi, M. Shahadat, und M. O. Ab. Kadir, „Supercritical Carbon Dioxide as Non-Thermal Alternative Technology for Safe Handling of Clinical Wastes“, Environ. Process., Bd. 2, Nr. 4, S. 797–822, Dez. 2015, doi: 10.1007/s40710-015-0116-0.
[27] Z. Lian, D. Yang, Y. Wang, L. Zhao, L. Rao, und X. Liao, „Investigating the microbial inactivation effect of low temperature high pressure carbon dioxide and its application in frozen prawn (Penaeus vannamei)“, Food Control, Bd. 145, S. 109401, März 2023, doi: 10.1016/j.foodcont.2022.109401.
[28] S. ‐I. Hong und Y. ‐R. Pyun, „Inactivation Kinetics of Lactobacillus plantarum by High Pressure Carbon Dioxide“, J. Food Sci., Bd. 64, Nr. 4, S. 728–733, Juli 1999, doi: 10.1111/j.1365-2621.1999.tb15120.x.
[29] S. R. Kim, M. S. Rhee, B. C. Kim, H. Lee, und K. H. Kim, „Modeling of the inactivation of Salmonella typhimurium by supercritical carbon dioxide in physiological saline and phosphate-buffered saline“, J. Microbiol. Methods, Bd. 70, Nr. 1, S. 132–141, Juli 2007, doi: 10.1016/j.mimet.2007.04.003.
[30] J. Li, A. Wang, F. Zhu, R. Xu, und X. S. Hu, „Membrane Damage Induced by Supercritical Carbon Dioxide in Rhodotorula mucilaginosa“, Indian J. Microbiol., Bd. 53, Nr. 3, S. 352–358, Sep. 2013, doi: 10.1007/s12088-013-0373-4.
[31] H. T. Vo u. a., „Comparison of disinfection effect of pressurized gases of CO2, N2O, and N2 on Escherichia coli“, Water Res., Bd. 47, Nr. 13, S. 4286–4293, Sep. 2013, doi: 10.1016/j.watres.2013.04.053.
[32] S. R. Kim, H. J. Park, D. S. Yim, H. T. Kim, I.-G. Choi, und K. H. Kim, „Analysis of survival rates and cellular fatty acid profiles of Listeria monocytogenes treated with supercritical carbon dioxide under the influence of cosolvents“, J. Microbiol. Methods, Bd. 75, Nr. 1, S. 47–54, Sep. 2008, doi: 10.1016/j.mimet.2008.04.012.
[33] L. Garcia-Gonzalez u. a., „High pressure carbon dioxide inactivation of microorganisms in foods: The past, the present and the future“, Int. J. Food Microbiol., Bd. 117, Nr. 1, S. 1–28, Juni 2007, doi: 10.1016/j.ijfoodmicro.2007.02.018.
[34] S. Spilimbergo, A. Bertucco, G. Basso, und G. Bertoloni, „Determination of extracellular and intracellular pH ofBacillus subtilis suspension under CO2 treatment“, Biotechnol. Bioeng., Bd. 92, Nr. 4, S. 447–451, Nov. 2005, doi: 10.1002/bit.20606.
[35] S.-I. Hong und Y.-R. Pyun, „Membrane damage and enzyme inactivation of Lactobacillus plantarum by high pressure CO2 treatment“, Int. J. Food Microbiol., Bd. 63, Nr. 1–2, S. 19–28, Jan. 2001, doi: 10.1016/S0168-1605(00)00393-7.
[36] A. Enomoto, K. Nakamura, K. Nagai, T. Hashimoto, und M. Hakoda, „Inactivation of Food Microorganisms by High-pressure Carbon Dioxide Treatment with or without Explosive Decompression“, Biosci. Biotechnol. Biochem., Bd. 61, Nr. 7, S. 1133–1137, Jan. 1997, doi: 10.1271/bbb.61.1133.
