Hochdruckbehandlung
Hochdruckprozesse zur Inaktivierung von Mikroorganismen sind seit einiger Zeit Gegenstand der Forschung und werden schon in speziellen Bereichen in der industriellen Praxis erfolgreich angewendet. In diesen hydrostatischen Hochdruckprozessen (HHP) werden die Behandlungsgüter Drücken von 6.000-10.000 bar (600 – 1000 MPa) ausgesetzt, um Mikroorganismen abzutöten [1]. Bei den Behandlungsgütern handelt es meist sich um Flüssigkeiten oder gelöste Stoffe. Aber auch die Behandlung von Feststoffen ist möglich, sofern diese in eine Flüssigkeit (z.B. Wasser) eingebracht werden können. Jedoch ist inaktivierende Wirkung gegenüber Mikroorganismen abhängig von der Art der Mikroorganismen, einige Bakterienarten überstehen HHP-Behandlung sehr gut [2]. Dies ist bei der Anwendung zu beachten. Neben HHP existieren noch weitere Hochdruckverfahren wie die Hochdruck Homogenisierung von Flüssigen Lebensmitteln [3]. Der Vorteil von Hochdruckprozessen liegt darin, dass eine Inaktivierung von Mikroorganismen alleine durch die Behandlung mit hohen Drücken und ohne Erwärmung oder Zugabe biozider Stoffe erfolgen kann. Diese Verfahren gelten daher als rückstandsfrei und besonders schonend. Die ursprünglichen Eigenschaften der Behandlungsgüter werden durch die Verfahren nur wenig verändert[4]. Aus diesem Grund finden Hochdruckprozesse Anwendung bei der Behandlung von Lebensmitteln, Gewürzen, pharmazeutischen Zubereitungen, etc. Eine auch aus dem Alltag bekannte Anwendung ist die Hochdrucksterilisation von hochwertigen und empfindlichen Produkten, wie frischen Direktsäften oder Frucht-Pürees, deren Geschmack durch Erhitzen zu stark verändert würde[5].
Diese Eigenschaften machen HPP und ähnliche Verfahren prinzipiell auch interessant für die Behandlung von Abwässern, um gezielt die mikrobielle Last zu senken und auch multiresistente Keime abzutöten. Diese Verfahren haben den Vorteil keine Biozide einzusetzen, die das Abwasser zusätzlich mit weiteren Stoffen belasten oder es energieintensiv erhitzen, das mit hohen Kosten und weiteren Problemen verbunden ist. Jedoch ist das Erzeugen von extrem hohen Drücken technisch sehr anspruchsvoll und hat hohe Anforderungen Technik und Material. Eine alternative zu HHP stellen Verfahren da, die auf komprimierte Gase wie Kohlenstoffdioxid (CO2), Lachgas (NO2) oder auch Stickstoff setzen und auch schon bei vergleichbar niedrigeren Drücken von unter 100 bar eine vergleichbare Inaktivierungswirkung zeigen. In diesem Beriech hat sich sogenanntes dense phase carbon dioxide (DPCO2 auch DPCD) als besonders effektiv erwiesen[6].
DPCO2
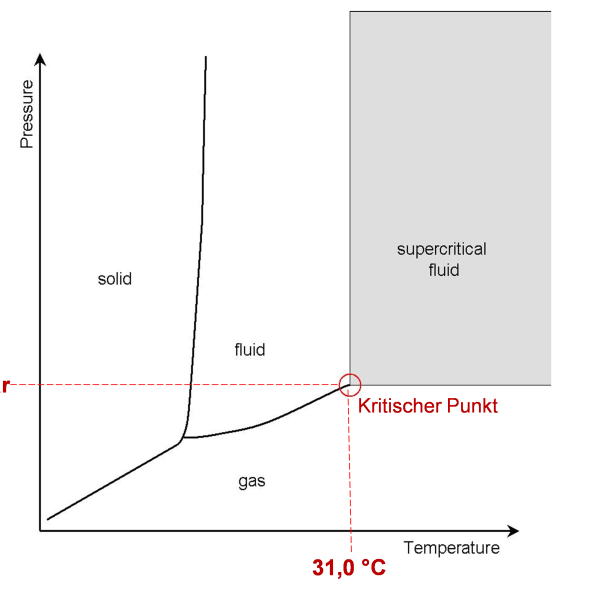
Kohlenstoffdioxid (CO2) ist ein Gas, das in der Erdatmosphäre mit einer Konzentration von ca. 420 ppm (0,04 %) vorkommt. Das Gas gelangt durch geologische Prozesse oder hauptsächlich über Oxidation von organischem Kohlenstoff durch technische und biologische Prozesse in Atmosphäre. So ist CO2 ein Produkt vieler Stoffwechselwege, wie der Zellatmung, und wird von den meisten Lebewesen ausgeschieden. Beispielsweise hat die Ausatemluft der Menschen hat einen Anteil von 3-6 % CO2. Die Dichte von gasförmigem CO2 übersteigt die von Luft, sodass es zu Boden sinkt. Es ist geruchs- und geschmacklos, jedoch gut in Wasser löslich und bildet in wässriger Lösung Kohlensäure, was zu einer Abnahme des pH-Wertes führt. Diese macht jedoch nur einen geringen Teil des gelösten Gases aus.CO2 sublimiert bei Atmosphärendruck bei -78,5 °C aus der festen in die gasförmige Phase, ohne dass es als flüssig wird. Erst bei einem Druck von 5,2 bar und einer Temperatur von < 56,6 °C, am sogenannten Tripelpunkt, kondensiert CO2 in eine Flüssigkeit. Diese wird in der Anwendung als „liquid CO2“, LCO2, bezeichnet. Der kritische Punkt von CO2 wird bei 73,8 bar und 31 °C erreicht, wo es in den überkritischen Zustand („supercritical CO2„, SCCO2) übergeht. In diesem Zustand lösen sich die Phasengrenzen auf und SCO2 zeigt sowohl die Eigenschaften eines Gases als auch die einer Flüssigkeit: Es besitzt die geringe Viskosität von gasförmigem CO2 und kann daher sehr leicht in feinste Poren von Festkörpermaterialien eindringe, aber gleichzeitig ist es ein gutes Lösemittel für unpolare organische Substanzen. Ein schematisches Phasendiagramm ist in Abb. 1 dargestellt. Die Bezeichnung „Komprimiertes Kohlendioxid“ (dense phase carbon dioxide, DPCO2) umfasst im Allgemeinen flüssiges Kohlendioxid (LCO2) oder superkritisches Kohlendioxid (SCCO2).
Die Beobachtung das CO2 antimikrobielle Eigenschaften besitzt, ist schon sehr lange bekannt. Das Gas ist zwar nicht giftig, jedoch können CO2-Konzentrationen von >8 % binnen 30-60 min zum Tode führen. Die „inhibitorischen Effekte auf Mikroben“ wurden erstmals zusammenfassend 1927 beschrieben [7]. Die antimikrobielle Wirkung, die durch die Verdrängung von Sauerstoff entsteht, ist ein Effekt, der in der Anwendung seit Jahrtausenden genutzt wird. Sie spielt während der Vergärung von Maischen in der Wein- und Bierherstellung eine Rolle, da durch das in der Gärung erzeugte CO2 aerobe Mikroorganismen wie Schimmelpilze, die ein Verderben verursachen können, am Wachstum gehindert werden ehe der Alkoholgehalt hoch genug ist. Darüber hinaus hemmt die Bildung von Kohlensäure das Wachstum von Mikroorganismen. Der Zusatz von Kohlendioxid zu Getränken verbessert nicht nur den Geschmack, sondern verlängert auch die Haltbarkeit. Dieser Effekt wird in der Getränkeindustrie bereits seit Langem genutzt [8].
Aber auch komprimiertes CO2, weist auch in der direkten Anwendung antimikrobielle Eigenschaften auf. Erste Untersuchungen, mit denen eine Inaktivierung durch komprimiertes CO2 erreicht wurde, wurden schon 1951 veröffentlicht [9]. Das Interesse an DPCO2-Verfahren ist seit den 1990er Jahren deutlich gestiegen. Zahlreiche Publikationen berichten über eine Wirksamkeit gegenüber Bakterien [2], [10], [11], [12], [13], [14], [15], [16], [17], [18], Pilzen [19], [20], [21], [22], [23], vereinzelt bakteriellen Endosporen [11], [24], [25]und Viren [26], [27]. Die ermittelten Inaktivierungsraten reichen bis über 9 log-Stufen in Abhängigkeit von den verwendeten Mikroorganismen, der verwendeten Phase (LCO2 / SCCO2), der Temperatur und dem Druck und der Inkubationsdauer.
Der genaue Mechanismus, wie DPCO2 zu einer Abtötung von Mikroorganismen führt, ist noch nicht vollständig aufgeklärt. Durch verschiedene Untersuchung ließen sich mehrere Effekte beobachten, die der antimikrobiellen Wirkung von komprimierten Kohlenstoffdioxid zu Grunde liegen. In den Untersuchungen konnten folgende Effekte beobachtet werden.
• Ansäuerung des die Mikroorganismen umgebenden Milieus: Wenn bei der Inkubation von Mikroorganismen in DPCO2 Wasser vorhanden ist, kommt es zur Bildung von Kohlensäure (H2CO3). Dadurch wird das umgebende Milieu angesäuert. Durch die Ansäuerung werden die für die Mikroorganismen wichtigen Protonengradienten gestört und damit der Stoffwechsel der Zellen erheblich beeinträchtigt. [28].
• TDie Diffusion des komprimierten CO2 in die aus Phospholipiden bestehende Zellmembran führt zu einer Abnahme der Membranfluidität. Dadurch werden die Struktur und Funktion der Membran erheblich gestört, was zur Folge hat, dass die Membran für andere Stoffe durchlässiger wird. Dadurch können zytotoxische Substanzen leichter in die Zelle eindringen und lebenswichtige Stoffe aus der Zelle diffundieren. Die Zellen können nicht mehr Stoffwechselgleichgewicht aufrecht erhalten [29], [30], [31].
• Darüber hinaus ist DPCO2 auch ein ausgezeichnetes Lösungsmittel. Dadurch können intrazelluläre Zellbestandteile gelöst und aus der Zelle extrahiert werden. So konnte der Austritt bestimmter Substanzen in das umgebende Medium nachgewiesen werden.[32]
• Komprimiertes CO2 dringt durch die Zellmembran in das Zytoplasma von Mikroorganismen ein und führt nach Bildung von Kohlensäure zu einer intrazellulären Absenkung des pH-Wertes. Die pH-Absenkung kann jedoch bei massivem CO2-Einstrom nicht kompensiert werden und führt dann zu einer Absenkung auf pH=3,3. Die Absenkung des intrazellulären pH-Wertes führt unter anderem zur Inaktivierung pH-sensitiver Schlüsselenzyme des Zellstoffwechsels.[33], [34]
• Die Bildung von Kohlensäure in den Zellen führt auch zu einer Änderung der Ionenkonzentration. Durch die Bildung schwerlöslicher Carbonatsalze und deren Ausfällung können zweiwertige Metallionen wie Mg2+ und Ca2+ abgeschieden werden. Diese fehlen dann im Stoffwechsel als Gradienten oder als Cofaktoren in Enzymen. Dadurch werden die Prozesse in der Zelle empfindlich gestört.[35]
• Weiterhin wird diskutiert, ob die Entspannung von DPCO2 Zellrupturen verursachen könnte, da das unter Hochdruck in die Zelle diffundierte CO2 bei plötzlicher Entspannung expandiert und in die Gasphase übergeht [31].In Aufnahmen mit Elektronenmikroskopen behandelter Bakterien lassen sich beschädigte Membranen erkennen. Ob dieser Effekt wirklich relevant ist , wird diskutiert, da nur sehr wenig Proteinmaterial aus den behandelten Zellen austritt [36].
Alle diese Effekte finden gleichzeitig statt und Es ist nicht auszuschließen, dass diese synergetisch in einander greifen.
Der Einsatz von DPCO2 in technologischen Anwendungen ist aus vielen Gründen vorteilhaft: Es ist nicht brennbar, nicht explosiv, nicht toxisch, nicht allergen, verdampft rückstandsfrei, relativ kostengünstig (~0,30 €/kg), leicht verfügbar und recycelbar. Die Desinfektion mit DPCO2 gilt als nicht-thermisches Verfahren und wird auch als kalte Pasteurisierung bezeichnet. Da sie bei niedrigen Temperaturen abläuft, kann sie auch als energiesparend angesehen werden, da ein energieintensives Aufheizen entfällt.
Während die Desinfektion mit DPCO2 zwar immer wieder diskutiert wird, aber noch nicht flächendeckend etabliert und Gegenstand dieses Forschungsvorhabens ist, wird DPCO2 in vielen anderen Bereichen bereits großtechnisch eingesetzt. So gibt es Verfahren zur Extraktion von Naturstoffen (z.B. Extraktion von Lupulin aus Hopfen, Entfernung von Koffein aus Kaffee), zur Imprägnierung von Holz, zum Einfärben von Kunststoffteilen und zur Behandlung von Reis und anderen Lebensmitteln. Hier liegen bereits Erfahrungen mit DPCO2 vor, auf denen aufgebaut werden kann.
All diese Eigenschaften machen den Einsatz von DPCO2 auch für die Abwasserbehandlung interessant, um hier ressourcenschonend die Anzahl multiresistenter Erreger zu reduzieren. Der Projektpartner wfk – cleaning technologies institute e.V. verfügt bereits über umfangreiche Erfahrungen im Umgang mit DPCO2 aus bereits abgeschlossenen Forschungsprojekten. Diese Expertise kann in die Entwicklung neuer Verfahren zur Reduzierung von MRE im Abwasser einfließen und einen wichtigen Baustein für SPOWAR liefern.
# Ausgewählte Literatur
[1] S. Koseki, M. Matsubara, und K. Yamamoto, „Prediction of a Required Log Reduction with Probability for Enterobacter sakazakii during High-Pressure Processing, Using a Survival/Death Interface Model“, Appl. Environ. Microbiol., Bd. 75, Nr. 7, S. 1885–1891, Apr. 2009, doi: 10.1128/AEM.02283-08.
[2] H. Gollwitzer u. a., „High Hydrostatic Pressure for Disinfection of Bone Grafts and Biomaterials: An Experimental Study“, Open Orthop. J., Bd. 3, Nr. 1, S. 1–7, Jan. 2009, doi: 10.2174/1874325000903010001.
[3] R. Levy, Z. Okun, und A. Shpigelman, „High-Pressure Homogenization: Principles and Applications Beyond Microbial Inactivation“, Food Eng. Rev., Bd. 13, Nr. 3, S. 490–508, Sep. 2021, doi: 10.1007/s12393-020-09239-8.
[4] R. Sehrawat, B. P. Kaur, P. K. Nema, S. Tewari, und L. Kumar, „Microbial inactivation by high pressure processing: principle, mechanism and factors responsible“, Food Sci. Biotechnol., Bd. 30, Nr. 1, S. 19–35, Jan. 2021, doi: 10.1007/s10068-020-00831-6.
[5] V. Chiozzi, S. Agriopoulou, und T. Varzakas, „Advances, Applications, and Comparison of Thermal (Pasteurization, Sterilization, and Aseptic Packaging) against Non-Thermal (Ultrasounds, UV Radiation, Ozonation, High Hydrostatic Pressure) Technologies in Food Processing“, Appl. Sci., Bd. 12, Nr. 4, S. 2202, Feb. 2022, doi: 10.3390/app12042202.
[6] H. T. Vo, T. Imai, T. T. Ho, T.-L. T. Dang, und S. A. Hoang, „Potential application of high pressure carbon dioxide in treated wastewater and water disinfection: Recent overview and further trends“, J. Environ. Sci., Bd. 36, S. 38–47, Okt. 2015, doi: 10.1016/j.jes.2015.04.006.
[7] G. Valley und L. F. Rettger, „THE INFLUENCE OF CARBON DIOXIDE ON BACTERIA“, J. Bacteriol., Bd. 14, Nr. 2, S. 101–137, Aug. 1927, doi: 10.1128/jb.14.2.101-137.1927.
[8] J. R. Donald, C. L. Jones, und A. R. M. MacLean, „THE EFFECT OF CARBONATION ON BACTERIA IN BEVERAGES“, Am. J. Public Health, Bd. 14, Nr. 2, S. 122–128, Feb. 1924, doi: 10.2105/AJPH.14.2.122.
[9] D. Fraser, „Bursting Bacteria by Release of Gas Pressure“, Nature, Bd. 167, Nr. 4236, S. 33–33, Jan. 1951, doi: 10.1038/167033a0.
[10] C. I. Wei, M. O. Balaban, S. Y. Fernando, und A. J. Peplow, „Bacterial Effect of High Pressure CO2 Treatment on Foods Spiked with Listeria or Salmonella“, J. Food Prot., Bd. 54, Nr. 3, S. 189–193, März 1991, doi: 10.4315/0362-028X-54.3.189.
[11] A. Enomoto, K. Nakamura, M. Hakoda, und N. Amaya, „Lethal effect of high-pressure carbon dioxide on a bacterial spore“, J. Ferment. Bioeng., Bd. 83, Nr. 3, S. 305–307, Jan. 1997, doi: 10.1016/S0922-338X(97)80999-3.
[12] H. Lin, N. Cao, und L. Chen, „Antimicrobial Effect of Pressurized Carbon Dioxide on Listeria monocytogenes“, J. Food Sci., Bd. 59, Nr. 3, S. 657–659, Mai 1994, doi: 10.1111/j.1365-2621.1994.tb05587.x.
[13] A. K. Dillow, F. Dehghani, J. S. Hrkach, N. R. Foster, und R. Langer, „Bacterial inactivation by using near- and supercritical carbon dioxide“, Proc. Natl. Acad. Sci., Bd. 96, Nr. 18, S. 10344–10348, Aug. 1999, doi: 10.1073/pnas.96.18.10344.
[14] F. Dehghani, N. Annabi, M. Titus, P. Valtchev, und A. Tumilar, „Sterilization of ginseng using a high pressure CO2 at moderate temperatures“, Biotechnol. Bioeng., Bd. 102, Nr. 2, S. 569–576, Feb. 2009, doi: 10.1002/bit.22059.
[15] C. Cinquemani, C. Boyle, E. Bach, und E. Schollmeyer, „Inactivation of microbes using compressed carbon dioxide—An environmentally sound disinfection process for medical fabrics“, J. Supercrit. Fluids, Bd. 42, Nr. 3, S. 392–397, Okt. 2007, doi: 10.1016/j.supflu.2006.11.001.
[16] L. Garcia-Gonzalez u. a., „Membrane permeabilization and cellular death of Escherichia coli, Listeria monocytogenes and Saccharomyces cerevisiae as induced by high pressure carbon dioxide treatment“, Food Microbiol., Bd. 27, Nr. 4, S. 541–549, Juni 2010, doi: 10.1016/j.fm.2009.12.004.
[17] A. Arbal u. a., „Dense phase carbon dioxide (DPCD) inactivation of microorganisms and enzymes, and its application in food: A review“, Food Chem. Adv., Bd. 5, S. 100782, Dez. 2024, doi: 10.1016/j.focha.2024.100782.
[18] T. Hochmuth, „Entwicklung neuartiger bioresorbierbarer Implantatmaterialien sowie kompatibler Sterilisationsverfahren“, wfk – cleaning technologies e.V., Krefeld; Dresden, Schlussbericht IGF-17455 BG, Sep. 2014.
[19] G. Ferrentino und S. Spilimbergo, „Non-thermal pasteurization of apples in syrup with dense phase carbon dioxide“, J. Food Eng., Bd. 207, S. 18–23, Aug. 2017, doi: 10.1016/j.jfoodeng.2017.03.014.
[20] G. J. Haas, H. E. Prescott, E. Dudley, R. Dik, C. Hintlian, und L. Keane, „INACTIVATION OF MICROORGANISMS BY CARBON DIOXIDE UNDER PRESSURE“, J. Food Saf., Bd. 9, Nr. 4, S. 253–265, Jan. 1989, doi: 10.1111/j.1745-4565.1989.tb00525.x.
[21] A. Bernhardt u. a., „Improved Sterilization of Sensitive Biomaterials with Supercritical Carbon Dioxide at Low Temperature“, PLOS ONE, Bd. 10, Nr. 6, S. e0129205, Juni 2015, doi: 10.1371/journal.pone.0129205.
[22] D. Mantoan und S. Spilimbergo, „Mathematical Modeling of Yeast Inactivation of Freshly Squeezed Apple Juice under High-Pressure Carbon Dioxide“, Crit. Rev. Food Sci. Nutr., Bd. 51, Nr. 1, S. 91–97, Dez. 2010, doi: 10.1080/10408390903044818.
[23] T. Parton, N. Elvassore, A. Bertucco, und G. Bertoloni, „High pressure CO2 inactivation of food: A multi-batch reactor system for inactivation kinetic determination“, J. Supercrit. Fluids, Bd. 40, Nr. 3, S. 490–496, Apr. 2007, doi: 10.1016/j.supflu.2006.07.022.
[24] J. Zhang u. a., „Sterilizing Bacillus pumilus spores using supercritical carbon dioxide“, J. Microbiol. Methods, Bd. 66, Nr. 3, S. 479–485, Sep. 2006, doi: 10.1016/j.mimet.2006.01.012.
[25] T. Watanabe u. a., „High Pressure Carbon Dioxide Decreases the Heat Tolerance of the Bacterial Spores“, Food Sci. Technol. Res., Bd. 9, Nr. 4, S. 342–344, 2003, doi: 10.3136/fstr.9.342.
[26] A. N. Efaq, N. N. N. Ab. Rahman, H. Nagao, A. A. Al-Gheethi, M. Shahadat, und M. O. Ab. Kadir, „Supercritical Carbon Dioxide as Non-Thermal Alternative Technology for Safe Handling of Clinical Wastes“, Environ. Process., Bd. 2, Nr. 4, S. 797–822, Dez. 2015, doi: 10.1007/s40710-015-0116-0.
[27] Z. Lian, D. Yang, Y. Wang, L. Zhao, L. Rao, und X. Liao, „Investigating the microbial inactivation effect of low temperature high pressure carbon dioxide and its application in frozen prawn (Penaeus vannamei)“, Food Control, Bd. 145, S. 109401, März 2023, doi: 10.1016/j.foodcont.2022.109401.
[28] S. ‐I. Hong und Y. ‐R. Pyun, „Inactivation Kinetics of Lactobacillus plantarum by High Pressure Carbon Dioxide“, J. Food Sci., Bd. 64, Nr. 4, S. 728–733, Juli 1999, doi: 10.1111/j.1365-2621.1999.tb15120.x.
[29] S. R. Kim, M. S. Rhee, B. C. Kim, H. Lee, und K. H. Kim, „Modeling of the inactivation of Salmonella typhimurium by supercritical carbon dioxide in physiological saline and phosphate-buffered saline“, J. Microbiol. Methods, Bd. 70, Nr. 1, S. 132–141, Juli 2007, doi: 10.1016/j.mimet.2007.04.003.
[30] J. Li, A. Wang, F. Zhu, R. Xu, und X. S. Hu, „Membrane Damage Induced by Supercritical Carbon Dioxide in Rhodotorula mucilaginosa“, Indian J. Microbiol., Bd. 53, Nr. 3, S. 352–358, Sep. 2013, doi: 10.1007/s12088-013-0373-4.
[31] H. T. Vo u. a., „Comparison of disinfection effect of pressurized gases of CO2, N2O, and N2 on Escherichia coli“, Water Res., Bd. 47, Nr. 13, S. 4286–4293, Sep. 2013, doi: 10.1016/j.watres.2013.04.053.
[32] S. R. Kim, H. J. Park, D. S. Yim, H. T. Kim, I.-G. Choi, und K. H. Kim, „Analysis of survival rates and cellular fatty acid profiles of Listeria monocytogenes treated with supercritical carbon dioxide under the influence of cosolvents“, J. Microbiol. Methods, Bd. 75, Nr. 1, S. 47–54, Sep. 2008, doi: 10.1016/j.mimet.2008.04.012.
[33] L. Garcia-Gonzalez u. a., „High pressure carbon dioxide inactivation of microorganisms in foods: The past, the present and the future“, Int. J. Food Microbiol., Bd. 117, Nr. 1, S. 1–28, Juni 2007, doi: 10.1016/j.ijfoodmicro.2007.02.018.
[34] S. Spilimbergo, A. Bertucco, G. Basso, und G. Bertoloni, „Determination of extracellular and intracellular pH ofBacillus subtilis suspension under CO2 treatment“, Biotechnol. Bioeng., Bd. 92, Nr. 4, S. 447–451, Nov. 2005, doi: 10.1002/bit.20606.
[35] S.-I. Hong und Y.-R. Pyun, „Membrane damage and enzyme inactivation of Lactobacillus plantarum by high pressure CO2 treatment“, Int. J. Food Microbiol., Bd. 63, Nr. 1–2, S. 19–28, Jan. 2001, doi: 10.1016/S0168-1605(00)00393-7.
[36] A. Enomoto, K. Nakamura, K. Nagai, T. Hashimoto, und M. Hakoda, „Inactivation of Food Microorganisms by High-pressure Carbon Dioxide Treatment with or without Explosive Decompression“, Biosci. Biotechnol. Biochem., Bd. 61, Nr. 7, S. 1133–1137, Jan. 1997, doi: 10.1271/bbb.61.1133.
