Bi-superkatalysatoren
Fotocatalystoren maken een chemische reactie mogelijk door excitatie met lichtenergie zonder zelf verbruikt te worden. Piëzo-elektrische katalysatoren worden geëxciteerd door mechanische actie zoals druk of spanning. In beide gevallen resulteert excitatie van de katalysator in de afscheiding van ladingsdragers op het katalysatoroppervlak, wat kan leiden tot de vorming van reactieve zuurstofspecies zoals hydroxylradicalen OH• en hyperperoxide-anionen O2•– in een waterig milieu. Uit deze radicalen kunnen weer andere reactieve zuurstofsoorten worden gevormd, zoals hydroperoxylradicalen HOO• en waterstofperoxide H2O2 [1]. Waterstofperoxide kan door de Fentonreactie weer worden gesplitst in twee hydroxylradicalen. De gevormde radicalen hebben meestal een korte levensduur en reageren direct met substraten in de directe omgeving. Ze hebben bijvoorbeeld een inactiverend effect op micro-organismen en kunnen organische verbindingen oxideren en zo afbreken [2]. Met een oxidatiepotentiaal van 2,8 V (vs. SHE) is het hydroxylradicaal OH• de meest reactieve zuurstofsoort en daarom bijzonder interessant voor oxidatieve afbraakprocessen [3].
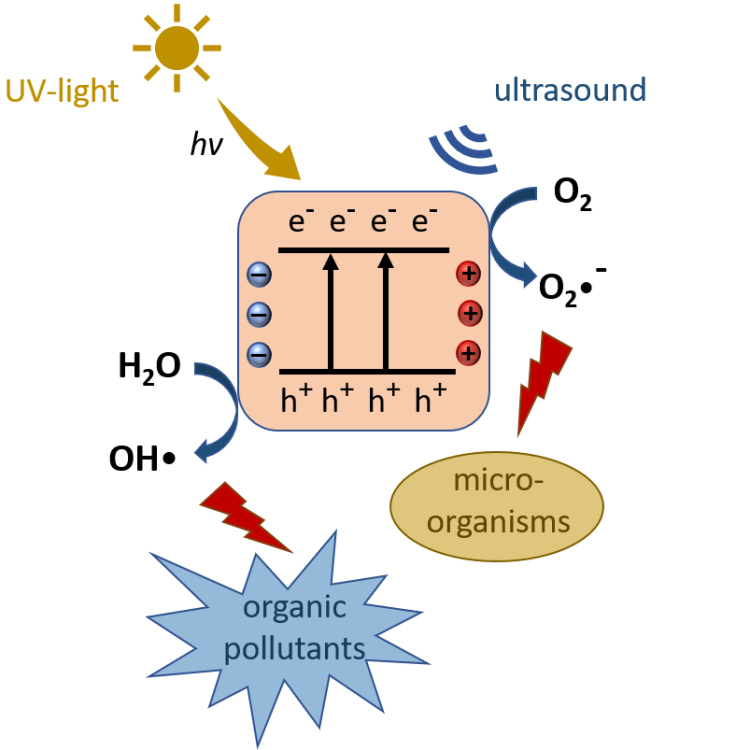
Fotokatalysatoren zoals titaniumdioxide (TiO2) kunnen direct hydroxylradicalen genereren. Onder invloed van ultraviolette (UV) straling worden elektronen overgedragen van de valentieband van de fotokatalysator naar de geleidingsband. Tegelijkertijd ontstaan er elektrongaten in de valentieband. Deze elektrongaten kunnen reageren met omringende watermoleculen en door oxidatie hydroxylradicalen genereren [4]. Om dit mogelijk te maken, moet het redoxpotentiaal van de valentieband echter positiever zijn dan dat van water (2,32 V) ten opzichte van de standaard waterstofelektrode (SHE)) [5]. Dit is bijvoorbeeld het geval bij titaniumdioxide. De elektronen in de geleidingsband kunnen reageren met zuurstof en hyperperoxide anionen genereren door reductie. Hiervoor moet het redoxpotentiaal van de geleidingsband negatiever zijn dan dat van zuurstof (-0,16 V vs. SHE) [5].Dit is ook het geval bij titaandioxide. De elektronen kunnen echter ook snel recombineren met de elektrongaten in de valentieband zonder dat er een chemische reactie plaatsvindt. Meer dan 90% van de elektron-gatparen recombineren binnen 10 ns na excitatie en zijn dan niet langer beschikbaar voor chemische reacties.6 Om de elektronen van de valentieband naar de geleidingsband over te brengen, moet de bandkloof worden overbrugd door excitatie met licht van een geschikte golflengte. Titaandioxide met een bandkloof van 3,0 – 3,2 eV kan worden geëxciteerd met UV-A-straling [7]. Fotokatalysatoren met een lagere bandkloof kunnen ook worden geëxciteerd met zichtbaar licht. Titaandioxide is een prominente fotokatalysator die al talloze toepassingen heeft gevonden vanwege zijn positieve eigenschappen [8].
Piëzokatalysatoren zijn kristalsystemen met een niet-centrosymmetrische kristalstructuur zoals perovskieten [9] Mechanische vervorming leidt tot de scheiding van ladingsdragers en de vorming van een piëzo-elektrisch veld. Dit kan de bandkloofstructuur en de oppervlakteladingsverdeling van een piëzokatalysator veranderen [10]. De meest onderzochte piëzokatalysatoren zijn loodzirkonaattitanaat (PZT), bariumtitanaat (BaTiO3) en zinkoxide (ZnO) [10,11].
Bi-superkatalysatoren combineren de eigenschappen van piëzo-elektrische katalysatoren en fotokatalysatoren en kunnen zowel mechanisch, bijvoorbeeld door ultrasone pulsen, als door UV-straling worden geëxciteerd. Door piëzo-elektrische materialen te combineren met fotokatalytische systemen kan de efficiëntie en stabiliteit van fotokatalytische reacties worden verbeterd. De recombinatiesnelheid van de ladingsdragers kan bijvoorbeeld worden verminderd, omdat in geëxciteerde piëzo-elektrische materialen een intern piëzo-elektrisch veld aanwezig is dat de elektronen en elektrongaten stabiliseert.
Als onderdeel van het project worden nieuwe fotopiezokatalytisch actieve bi-super-katalysatormaterialen geproduceerd die de efficiënte en continue generatie van reactieve zuurstofspecies mogelijk maken. Enerzijds worden de katalysatoren geëxciteerd met licht (bv. UV-A), dat met een betere efficiëntie en kosteneffectievere excitatiebronnen kan worden geproduceerd dan UV-C-licht. Bovendien wordt UV-A-licht minder geabsorbeerd door de te behandelen waterige media, waardoor deze efficiënter kunnen worden behandeld. De exciteerbaarheid van de bi-superkatalysatoren door ultrasone of hogedrukpulsen maakt ook de behandeling mogelijk van organisch sterk verontreinigde waterkwaliteiten die moeilijk toegankelijk zijn voor actinische behandeling door troebelheid of hoge extinctie (lichtverzwakking).
[1] Kumar, P.; Vaish, R.; Sung, T. H.; Hwang, W.; Park, H. K. B.; Kumar, A.; Kebaili, I.; Boukhris, I. Effect of Poling on Photocatalysis, Piezocatalysis, and Photo–Piezo Catalysis Performance of BaBi4 Ti4 O15 Ceramics. Glob. Chall. 2023, 7 (2), 2200142. https://doi.org/10.1002/gch2.202200142.
[2] Sharma, A.; Bhardwaj, U.; Jain, D.; Kushwaha, H. S. NaNbO3/ZnO Piezocatalyst for Non-Destructive Tooth Cleaning and Antibacterial Activity. iScience 2022, 25 (9), 104915. https://doi.org/10.1016/j.isci.2022.104915.
[3] Guerra-Rodríguez, S.; Rodríguez, E.; Singh, D.; Rodríguez-Chueca, J. Assessment of Sulfate Radical-Based Advanced Oxidation Processes for Water and Wastewater Treatment: A Review. Water 2018, 10 (12), 1828. https://doi.org/10.3390/w10121828.
[4] Ishibashi, K.; Nosaka, Y.; Hashimoto, K.; Fujishima, A. Time-Dependent Behavior of Active Oxygen Species Formed on Photoirradiated TiO2 Films in Air. J. Phys. Chem. B 1998, 102 (12), 2117–2120. https://doi.org/10.1021/jp973401i.
[5] Khan, Y.; Khan, M. N.; Salam, A.; Sadia, H.; Ullah, M. F.; Khan, M. I.; Abdullaeva, B. S.; Awwad, F. A.; Ismail, E. A. A. Photocatalytic Treatment of Organic Dyes Using Metal Oxides and Nanocomposites: A Quantitative Study. Open Chem. 2024, 22 (1), 20240026. https://doi.org/10.1515/chem-2024-0026.
[6] Zhang, L.; Mohamed, H. H.; Dillert, R.; Bahnemann, D. Kinetics and Mechanisms of Charge Transfer Processes in Photocatalytic Systems: A Review. J. Photochem. Photobiol. C Photochem. Rev. 2012, 13 (4), 263–276. https://doi.org/10.1016/j.jphotochemrev.2012.07.002.
[7] Hernández-Alonso, M. D.; Fresno, F.; Suárez, S.; Coronado, J. M. Development of Alternative Photocatalysts to TiO2: Challenges and Opportunities. Energy Environ. Sci. 2009, 2 (12), 1231. https://doi.org/10.1039/b907933e.
[8] Akakuru, O. U.; Iqbal, Z. M.; Wu, A. TiO2 Nanoparticles: Properties and Applications.
[9] Nkwachukwu, O. V.; Arotiba, O. A. Perovskite Oxide–Based Materials for Photocatalytic and Photoelectrocatalytic Treatment of Water. Front. Chem. 2021, 9, 634630. https://doi.org/10.3389/fchem.2021.634630.
[10] Jiang, T.; Wang, Y.; Cai, C.; Nie, C.; Peng, H.; Ao, Z. Piezocatalysis for Water Treatment: Mechanisms, Recent Advances, and Future Prospects. Environ. Sci. Ecotechnology 2025, 23, 100495. https://doi.org/10.1016/j.ese.2024.100495.
[11] Qurbani, K.; Amiri, O.; Hamzah, H. Piezocatalysts as Antimicrobial Agents: A Promising Frontier in Pathogenic Bacteria Control. J. Hazard. Mater. Adv. 2025, 17, 100546. https://doi.org/10.1016/j.hazadv.2024.100546.
